摘要:一項研究表明,維持干擾素-γ 和細胞外信號調節激酶/絲裂原活化蛋白激酶信號之間的微妙平衡對于在衰老過程中保存腸道干細胞群至關重要。
最近由副教授Takuya Yamamoto和研究員May Nakajima-Koyama領導的一項研究表明,維持干擾素-γ (IFN-γ)和細胞外信號調節激酶(ERK)/絲裂原活化蛋白激酶(MAPK)信號之間的微妙平衡對于在衰老過程中保存腸道干細胞群至關重要。
通過比較年輕小鼠和老年小鼠腸道組織,研究人員發現了這些信號通路之間的相互作用,這些信號通路隨著時間的推移支持干細胞的維持。
 圖1 IFN-γ和ERK/MAPK信號傳導活性之間的平衡確保了腸道干細胞的終身維持
圖1 IFN-γ和ERK/MAPK信號傳導活性之間的平衡確保了腸道干細胞的終身維持腸上皮是成人體內細胞周轉率最高的細胞,需要腸干細胞(ISCs)持續而精確的調節來維持新的吸收性腸細胞和分泌細胞的產生,包括Paneth、杯狀細胞、簇狀細胞和腸內分泌細胞。在來自干細胞生態位和周圍免疫細胞的生長因子和細胞因子的驅動下,多種信號通路密切調節ISC的自我更新和分化。
盡管腸道環境發生了與衰老相關的變化,但ISCs仍會不斷產生新的細胞,從而在整個生命周期中維持這種高周轉率,這表明存在保護ISCs免受微環境波動影響的保護機制。然而,潛在的機制在很大程度上仍然未知。
為了了解衰老如何影響ISCs,研究小組檢查了年輕(2-4個月大)和老年(22-27個月大)小鼠的腸道組織,這些小鼠的平均壽命約為兩年。研究人員使用具有Lgr5報告基因(ISCs的標記基因)的小鼠,發現即使隨著年齡的增長,ISC庫也能保持不變。
組織學分析進一步表明,盡管ISCs的增殖能力保持不變,但祖細胞的增殖能力隨著年齡的增長而下降。此外,他們觀察到ISCs向腸內分泌細胞的分化增強,腸內分泌細胞產生腸道激素,并在調節全身代謝中發揮關鍵作用。
為了更深入地了解與衰老相關的變化,研究人員分析了來自年輕和老年腸道的10,000多個單個細胞的基因表達譜,以在單細胞水平上檢查它們的基因表達模式。他們的分析確定了細胞類型特異性,年齡相關的基因表達改變,腸細胞成熟的顯著變化。
此外,他們觀察到代謝基因的年齡依賴性上調,這表明與年輕的腸細胞相比,衰老的腸細胞可能經歷了更強的成熟和代謝適應。這些發現表明,分化細胞可能比ISCs更容易受到衰老的影響。
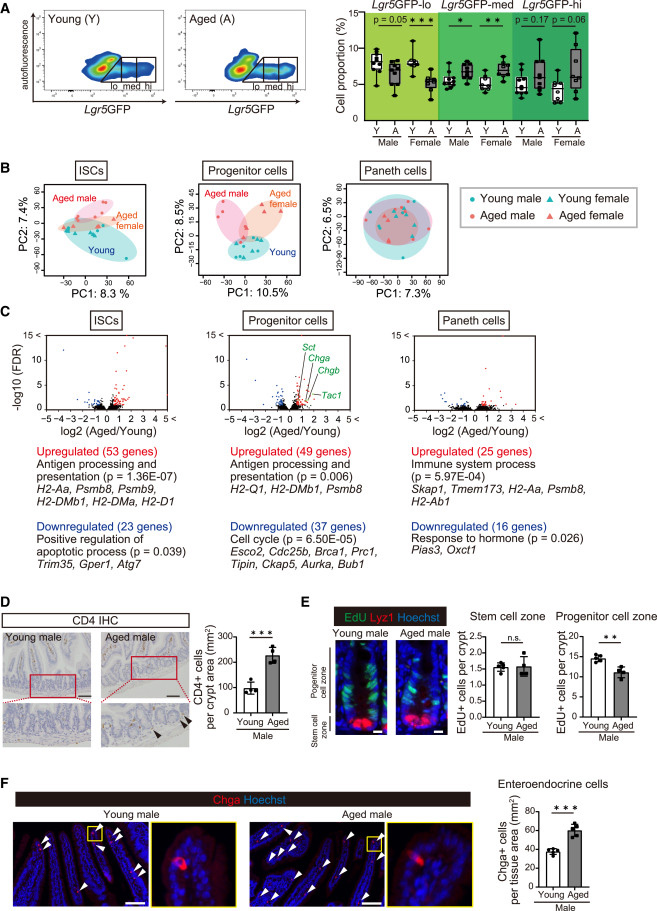
圖2 衰老對ISC自我更新和分化的影響
為了揭示腸上皮中年齡依賴性細胞和轉錄組變化的調控機制,研究人員首先確定了衰老標志物,通過將其表達作為指標來確定上游因素。通過對公共數據集進行綜合分析,他們發現MHC II類基因Ceacam10和Ly6e是ISCs在衰老過程中顯著上調的衰老標志物。盡管這些基因的表達在衰老的ISCs中升高,但它們在單細胞水平上并不相關,因此表明涉及多個獨立的調控機制。
接下來,研究人員進行了計算機分析,以預測上游調節因子,并確定了幾種可能有助于誘導衰老標記的候選信號通路。為了驗證這些途徑的參與,他們用已知影響候選途徑的生物活性分子處理了腸道類器官——培養中的微型腸道。
他們的研究結果表明,IFN-γ信號激活和ERK/MAPK信號失活有助于腸上皮的年齡相關變化。通過小鼠模型,研究人員進一步證實,隨著年齡的增長,這些信號的改變發生在小腸中。然而,這些信號變化對腸道穩態的綜合影響仍有待充分闡明。
為了研究這些通路的變化如何影響ISCs,研究人員用IFN-γ和iMEK (MEK/ERK MAPK信號的抑制劑)處理腸道類器官。值得注意的是,iMEK誘導ISCs處于靜止狀態,IFN-γ處理可逆轉這一狀態。此外,他們證明了iMEK和IFN-γ聯合治療減輕了單獨一種分子引起的類器官損傷,這表明這兩種信號通路以代償方式支持類器官的生長和存活。
機制上,轉錄組分析顯示IFN-γ逆轉了大多數imek誘導的全局轉錄組變化,部分通過調節Wnt/β-catenin信號傳導和轉錄因子Myc。相反,iMEK或IFN-γ單獨觸發腸內分泌細胞和腸細胞的年齡相關變化。這些發現表明,雖然IFN-γ和ERK/MAPK信號傳導之間的平衡對ISC維持至關重要,但它可能同時驅動分化細胞中與年齡相關的變化和功能障礙。
本研究表明,ERK/MAPK與IFN-γ信號的相互作用在腸上皮細胞衰老中起關鍵作用。研究結果表明,哺乳動物腸上皮已經進化出一種信號機制,優先保存ISCs,可能以犧牲分化細胞為代價,這可能有助于體內與年齡相關的代謝變化。
同時恢復ERK/MAPK和IFN-γ信號活性到更年輕的狀態可能是一種有希望的抗衰老治療策略,對ISCs的影響最小。
參考資料
[1] The balance between IFN-γ and ERK/MAPK signaling activities ensures lifelong maintenance of intestinal stem cells
摘要:一項研究表明,維持干擾素-γ 和細胞外信號調節激酶/絲裂原活化蛋白激酶信號之間的微妙平衡對于在衰老過程中保存腸道干細胞群至關重要。
最近由副教授Takuya Yamamoto和研究員May Nakajima-Koyama領導的一項研究表明,維持干擾素-γ (IFN-γ)和細胞外信號調節激酶(ERK)/絲裂原活化蛋白激酶(MAPK)信號之間的微妙平衡對于在衰老過程中保存腸道干細胞群至關重要。
通過比較年輕小鼠和老年小鼠腸道組織,研究人員發現了這些信號通路之間的相互作用,這些信號通路隨著時間的推移支持干細胞的維持。
 圖1 IFN-γ和ERK/MAPK信號傳導活性之間的平衡確保了腸道干細胞的終身維持
圖1 IFN-γ和ERK/MAPK信號傳導活性之間的平衡確保了腸道干細胞的終身維持腸上皮是成人體內細胞周轉率最高的細胞,需要腸干細胞(ISCs)持續而精確的調節來維持新的吸收性腸細胞和分泌細胞的產生,包括Paneth、杯狀細胞、簇狀細胞和腸內分泌細胞。在來自干細胞生態位和周圍免疫細胞的生長因子和細胞因子的驅動下,多種信號通路密切調節ISC的自我更新和分化。
盡管腸道環境發生了與衰老相關的變化,但ISCs仍會不斷產生新的細胞,從而在整個生命周期中維持這種高周轉率,這表明存在保護ISCs免受微環境波動影響的保護機制。然而,潛在的機制在很大程度上仍然未知。
為了了解衰老如何影響ISCs,研究小組檢查了年輕(2-4個月大)和老年(22-27個月大)小鼠的腸道組織,這些小鼠的平均壽命約為兩年。研究人員使用具有Lgr5報告基因(ISCs的標記基因)的小鼠,發現即使隨著年齡的增長,ISC庫也能保持不變。
組織學分析進一步表明,盡管ISCs的增殖能力保持不變,但祖細胞的增殖能力隨著年齡的增長而下降。此外,他們觀察到ISCs向腸內分泌細胞的分化增強,腸內分泌細胞產生腸道激素,并在調節全身代謝中發揮關鍵作用。
為了更深入地了解與衰老相關的變化,研究人員分析了來自年輕和老年腸道的10,000多個單個細胞的基因表達譜,以在單細胞水平上檢查它們的基因表達模式。他們的分析確定了細胞類型特異性,年齡相關的基因表達改變,腸細胞成熟的顯著變化。
此外,他們觀察到代謝基因的年齡依賴性上調,這表明與年輕的腸細胞相比,衰老的腸細胞可能經歷了更強的成熟和代謝適應。這些發現表明,分化細胞可能比ISCs更容易受到衰老的影響。

圖2 衰老對ISC自我更新和分化的影響
為了揭示腸上皮中年齡依賴性細胞和轉錄組變化的調控機制,研究人員首先確定了衰老標志物,通過將其表達作為指標來確定上游因素。通過對公共數據集進行綜合分析,他們發現MHC II類基因Ceacam10和Ly6e是ISCs在衰老過程中顯著上調的衰老標志物。盡管這些基因的表達在衰老的ISCs中升高,但它們在單細胞水平上并不相關,因此表明涉及多個獨立的調控機制。
接下來,研究人員進行了計算機分析,以預測上游調節因子,并確定了幾種可能有助于誘導衰老標記的候選信號通路。為了驗證這些途徑的參與,他們用已知影響候選途徑的生物活性分子處理了腸道類器官——培養中的微型腸道。
他們的研究結果表明,IFN-γ信號激活和ERK/MAPK信號失活有助于腸上皮的年齡相關變化。通過小鼠模型,研究人員進一步證實,隨著年齡的增長,這些信號的改變發生在小腸中。然而,這些信號變化對腸道穩態的綜合影響仍有待充分闡明。
為了研究這些通路的變化如何影響ISCs,研究人員用IFN-γ和iMEK (MEK/ERK MAPK信號的抑制劑)處理腸道類器官。值得注意的是,iMEK誘導ISCs處于靜止狀態,IFN-γ處理可逆轉這一狀態。此外,他們證明了iMEK和IFN-γ聯合治療減輕了單獨一種分子引起的類器官損傷,這表明這兩種信號通路以代償方式支持類器官的生長和存活。
機制上,轉錄組分析顯示IFN-γ逆轉了大多數imek誘導的全局轉錄組變化,部分通過調節Wnt/β-catenin信號傳導和轉錄因子Myc。相反,iMEK或IFN-γ單獨觸發腸內分泌細胞和腸細胞的年齡相關變化。這些發現表明,雖然IFN-γ和ERK/MAPK信號傳導之間的平衡對ISC維持至關重要,但它可能同時驅動分化細胞中與年齡相關的變化和功能障礙。
本研究表明,ERK/MAPK與IFN-γ信號的相互作用在腸上皮細胞衰老中起關鍵作用。研究結果表明,哺乳動物腸上皮已經進化出一種信號機制,優先保存ISCs,可能以犧牲分化細胞為代價,這可能有助于體內與年齡相關的代謝變化。
同時恢復ERK/MAPK和IFN-γ信號活性到更年輕的狀態可能是一種有希望的抗衰老治療策略,對ISCs的影響最小。
參考資料
[1] The balance between IFN-γ and ERK/MAPK signaling activities ensures lifelong maintenance of intestinal stem cells



