摘要:研究人員揭示了單胺類神經遞質如何通過這些單胺類神經遞質與組蛋白的化學結合。
西奈山和紀念斯隆凱特琳癌癥中心之間的合作努力,揭示了單胺類神經遞質(如血清素、多巴胺和組胺)如何通過這些單胺類神經遞質與組蛋白(我們細胞的核心DNA包裝蛋白)的化學結合,幫助調節大腦生理和行為。
通過揭示這些組蛋白修飾如何影響大腦,研究小組已經確定了一種控制晝夜基因表達和行為節律的新機制。該團隊的研究結果發表在1月8日星期三的《自然》雜志上,最終可能指導針對晝夜節律紊亂的疾病(如失眠、抑郁、雙相情感障礙和神經退行性疾病)的靶向治療的發展。
 圖1 雙向組蛋白單胺化動力學調節神經節律
圖1 雙向組蛋白單胺化動力學調節神經節律“我們的研究結果強調,大腦的內部時鐘受到化學單胺類神經遞質以一種以前未被認識到的方式的影響,例如單胺類可以直接修改組蛋白,而組蛋白反過來又調節大腦晝夜節律基因表達模式、神經可塑性和睡眠或清醒活動。”首席作者Ian Maze博士說,他是霍華德休斯醫學研究所研究員,西奈山伊坎醫學院神經科學和藥理學教授,西奈山神經表觀基因組工程中心主任。
“這一突破性的機制首次揭示了刺激大腦中神經遞質信號傳導(反之亦然)的晝夜節律事件如何通過直接改變DNA結構對神經元施加動態影響,”Yael David博士補充道,他是一位化學生物學家,領導著紀念斯隆凱特琳癌癥中心的Yael David實驗室,也是該研究的共同主要作者。“我們致力于更全面地了解這些機制,以便這項工作最終有助于開發治療晝夜節律相關疾病和其他腦部疾病的治療策略。”
迷宮實驗室過去的研究發現,血清素和多巴胺除了作為神經遞質(在神經細胞之間傳遞信號的化學信使,控制著許多重要的身體功能)的作用外,還可以附著在組蛋白上,特別是H3。這些蛋白直接調節大腦中的基因表達程序,這些程序有助于復雜的生物過程和行為(包括神經發育、藥物復發易感性和應激易感性),并在受到干擾時導致疾病。實驗室進一步了解到,負責用血清素和多巴胺修飾組蛋白的酶是轉谷氨酰胺酶2 (TG2)。
在他們的最新研究中,來自納什家族神經科學系、西奈山弗里德曼腦研究所和紀念斯隆凱特琳癌癥中心的研究人員使用了一種高度跨學科的方法來破譯TG2的生化機制。研究小組發現,TG2作為細胞內單胺類神經遞質的調節劑,不僅能將單胺類神經遞質添加到組蛋白H3上,還能在H3上擦除和交換一種單胺類神經遞質,不同的單胺通過獨立的機制控制基因表達模式。
“這個想法源于對TG2及其輔助因子形成的化學中間體的簡單觀察,揭示了一種新的動態,”該研究的第一作者Qingfei Zheng博士說,他曾是David實驗室的博士后,現在是普渡大學的一名教員。
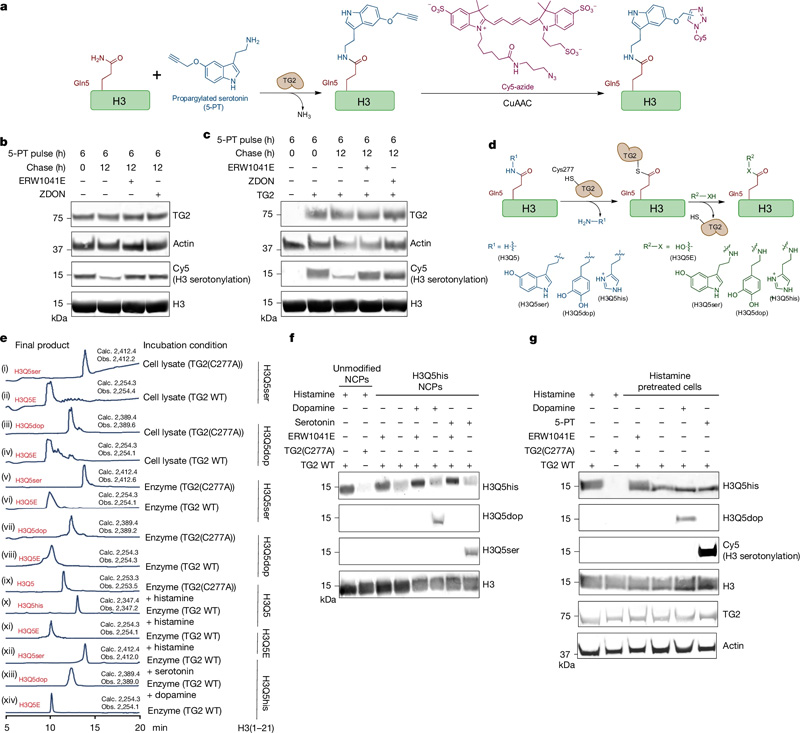
圖2 TG2是H3單胺基化的寫入、擦除和交換工具
Maze博士解釋說:“這些發現是同類研究中的第一個,這意味著大腦的多個區域可以容納異質性的單胺,它們可能會在外部刺激下迅速交換組蛋白上的單胺,從而直接調節基因表達程序。”
“這種獨特的機制表明,額外的組蛋白單胺修飾可能是動態調節的,可能在控制大腦中的復雜事件中發揮作用,”David博士補充說。
基于這種新的作用機制,研究小組推測細胞內單胺濃度的波動可能導致它們被TG2選擇性利用,從而引發新的組蛋白修飾。事實上,研究人員發現組胺化(指TG2與代謝性供體組胺的反應)是組蛋白的一種新的修飾,并表明它與相關的H3 - 5 -羥色胺化過程一起,在調節小鼠大腦的晝夜節律和晝夜行為中起著關鍵作用。
“組胺化還表明,我們的大腦如何控制睡眠/覺醒周期是一種新的神經傳遞獨立機制,而睡眠/覺醒周期在許多疾病中都被打亂了,”Maze博士說。
考慮到組胺在其他生物過程和疾病狀態中發揮的關鍵作用,包括免疫系統調節和癌癥,研究人員現在對進一步探索如何控制TG2依賴性組蛋白單胺化感興趣。
“通過闡明TG2調節機制,我們可能能夠對單胺能失調疾病,包括抑郁癥、精神分裂癥和帕金森病,獲得有價值的見解。我們的工作真正代表了一項基礎研究,有望導致更先進的人類研究,具有重要的治療意義,”Maze博士總結道。
參考資料
[1] Bidirectional histone monoaminylation dynamics regulate neural rhythmicity
摘要:研究人員揭示了單胺類神經遞質如何通過這些單胺類神經遞質與組蛋白的化學結合。
西奈山和紀念斯隆凱特琳癌癥中心之間的合作努力,揭示了單胺類神經遞質(如血清素、多巴胺和組胺)如何通過這些單胺類神經遞質與組蛋白(我們細胞的核心DNA包裝蛋白)的化學結合,幫助調節大腦生理和行為。
通過揭示這些組蛋白修飾如何影響大腦,研究小組已經確定了一種控制晝夜基因表達和行為節律的新機制。該團隊的研究結果發表在1月8日星期三的《自然》雜志上,最終可能指導針對晝夜節律紊亂的疾病(如失眠、抑郁、雙相情感障礙和神經退行性疾病)的靶向治療的發展。
 圖1 雙向組蛋白單胺化動力學調節神經節律
圖1 雙向組蛋白單胺化動力學調節神經節律“我們的研究結果強調,大腦的內部時鐘受到化學單胺類神經遞質以一種以前未被認識到的方式的影響,例如單胺類可以直接修改組蛋白,而組蛋白反過來又調節大腦晝夜節律基因表達模式、神經可塑性和睡眠或清醒活動。”首席作者Ian Maze博士說,他是霍華德休斯醫學研究所研究員,西奈山伊坎醫學院神經科學和藥理學教授,西奈山神經表觀基因組工程中心主任。
“這一突破性的機制首次揭示了刺激大腦中神經遞質信號傳導(反之亦然)的晝夜節律事件如何通過直接改變DNA結構對神經元施加動態影響,”Yael David博士補充道,他是一位化學生物學家,領導著紀念斯隆凱特琳癌癥中心的Yael David實驗室,也是該研究的共同主要作者。“我們致力于更全面地了解這些機制,以便這項工作最終有助于開發治療晝夜節律相關疾病和其他腦部疾病的治療策略。”
迷宮實驗室過去的研究發現,血清素和多巴胺除了作為神經遞質(在神經細胞之間傳遞信號的化學信使,控制著許多重要的身體功能)的作用外,還可以附著在組蛋白上,特別是H3。這些蛋白直接調節大腦中的基因表達程序,這些程序有助于復雜的生物過程和行為(包括神經發育、藥物復發易感性和應激易感性),并在受到干擾時導致疾病。實驗室進一步了解到,負責用血清素和多巴胺修飾組蛋白的酶是轉谷氨酰胺酶2 (TG2)。
在他們的最新研究中,來自納什家族神經科學系、西奈山弗里德曼腦研究所和紀念斯隆凱特琳癌癥中心的研究人員使用了一種高度跨學科的方法來破譯TG2的生化機制。研究小組發現,TG2作為細胞內單胺類神經遞質的調節劑,不僅能將單胺類神經遞質添加到組蛋白H3上,還能在H3上擦除和交換一種單胺類神經遞質,不同的單胺通過獨立的機制控制基因表達模式。
“這個想法源于對TG2及其輔助因子形成的化學中間體的簡單觀察,揭示了一種新的動態,”該研究的第一作者Qingfei Zheng博士說,他曾是David實驗室的博士后,現在是普渡大學的一名教員。

圖2 TG2是H3單胺基化的寫入、擦除和交換工具
Maze博士解釋說:“這些發現是同類研究中的第一個,這意味著大腦的多個區域可以容納異質性的單胺,它們可能會在外部刺激下迅速交換組蛋白上的單胺,從而直接調節基因表達程序。”
“這種獨特的機制表明,額外的組蛋白單胺修飾可能是動態調節的,可能在控制大腦中的復雜事件中發揮作用,”David博士補充說。
基于這種新的作用機制,研究小組推測細胞內單胺濃度的波動可能導致它們被TG2選擇性利用,從而引發新的組蛋白修飾。事實上,研究人員發現組胺化(指TG2與代謝性供體組胺的反應)是組蛋白的一種新的修飾,并表明它與相關的H3 - 5 -羥色胺化過程一起,在調節小鼠大腦的晝夜節律和晝夜行為中起著關鍵作用。
“組胺化還表明,我們的大腦如何控制睡眠/覺醒周期是一種新的神經傳遞獨立機制,而睡眠/覺醒周期在許多疾病中都被打亂了,”Maze博士說。
考慮到組胺在其他生物過程和疾病狀態中發揮的關鍵作用,包括免疫系統調節和癌癥,研究人員現在對進一步探索如何控制TG2依賴性組蛋白單胺化感興趣。
“通過闡明TG2調節機制,我們可能能夠對單胺能失調疾病,包括抑郁癥、精神分裂癥和帕金森病,獲得有價值的見解。我們的工作真正代表了一項基礎研究,有望導致更先進的人類研究,具有重要的治療意義,”Maze博士總結道。
參考資料
[1] Bidirectional histone monoaminylation dynamics regulate neural rhythmicity



