摘要:一研究人員發(fā)現(xiàn),氘化水通過調(diào)節(jié)TRPV1離子通道來減輕疼痛。
新加坡國立大學的研究人員發(fā)現(xiàn),氘化水通過調(diào)節(jié)TRPV1離子通道來減輕疼痛,為傳統(tǒng)止痛藥提供了一種不會上癮的替代品。
新加坡國立大學(NUS)的研究人員與中國北京大學合作,發(fā)現(xiàn)了TRPV1(瞬時受體電位香草素1)離子通道及其在疼痛感知中的作用的新見解。他們的發(fā)現(xiàn)證明了溶劑分子如何影響疼痛信號,為潛在的更安全、非成癮性疼痛管理策略的發(fā)展鋪平了道路。
 圖1 通過抑制TRPV1離子通道的水滲透進行溶劑介導(dǎo)的鎮(zhèn)痛
圖1 通過抑制TRPV1離子通道的水滲透進行溶劑介導(dǎo)的鎮(zhèn)痛有效的疼痛管理對于提高生活質(zhì)量和整體健康至關(guān)重要。TRPV1離子通道在檢測疼痛中起著關(guān)鍵作用,當被激活時,它的孔會擴大,使離子和更大的分子能夠通過。然而,水分子滲透TRPV1通道的能力仍然不確定。
創(chuàng)新納米探針跟蹤水動力學
為了解決這個問題,新加坡國立大學化學系Xiaogang Liu教授領(lǐng)導(dǎo)的研究小組開發(fā)了一種上轉(zhuǎn)換納米探針,能夠區(qū)分普通水和氘水。這種先進的技術(shù)可以在單細胞和單分子水平上實時跟蹤水動力學。研究表明,當氘水通過TRPV1通道時,可以抑制疼痛信號的傳遞,達到有效的鎮(zhèn)痛效果。這項研究是與北京大學和中國國防科技創(chuàng)新研究所的 Chang Chao教授以及在耶魯-新加坡國立大學學院期間的Zhuang Bilin助理教授合作進行的。
研究結(jié)果發(fā)表在2024年11月21日的《Nature Biomedical Engineering》雜志上。
給臨床前模型注射氘水,團隊成功地減少了急性和慢性炎癥性疼痛的傳播,而不影響其他神經(jīng)反應(yīng)。這種溶劑介導(dǎo)的鎮(zhèn)痛機制提供了一種有效的、生物相容性的、非成癮性的傳統(tǒng)止痛藥替代品,避免了與藥物依賴和耐受性相關(guān)的問題。
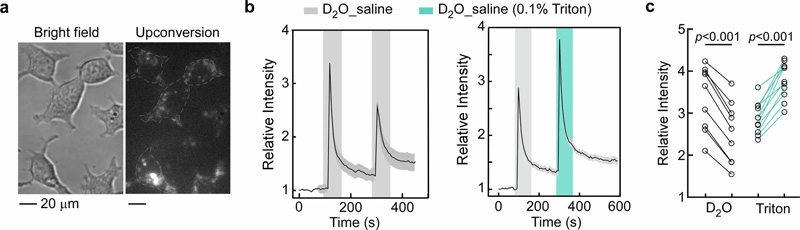
圖2 使用納米探針監(jiān)測單個活細胞中水環(huán)境的變化
Liu教授說:“這一發(fā)現(xiàn)不僅擴大了對TRPV1功能的科學認識,而且為疼痛管理開辟了新的途徑。研究小組的目標是進一步探索d2 O對其他離子通道的影響,潛在地將這種機制應(yīng)用于治療神經(jīng)系統(tǒng)疾病和其他醫(yī)學挑戰(zhàn)。”
“溶劑介導(dǎo)的鎮(zhèn)痛機制代表了疼痛緩解的創(chuàng)新突破,可能推動臨床使用更安全,非成癮性疼痛療法的發(fā)展,”Liu教授補充說。
參考資料
[1] Solvent-mediated analgesia via the suppression of water permeation through TRPV1 ion channels
摘要:一研究人員發(fā)現(xiàn),氘化水通過調(diào)節(jié)TRPV1離子通道來減輕疼痛。
新加坡國立大學的研究人員發(fā)現(xiàn),氘化水通過調(diào)節(jié)TRPV1離子通道來減輕疼痛,為傳統(tǒng)止痛藥提供了一種不會上癮的替代品。
新加坡國立大學(NUS)的研究人員與中國北京大學合作,發(fā)現(xiàn)了TRPV1(瞬時受體電位香草素1)離子通道及其在疼痛感知中的作用的新見解。他們的發(fā)現(xiàn)證明了溶劑分子如何影響疼痛信號,為潛在的更安全、非成癮性疼痛管理策略的發(fā)展鋪平了道路。
 圖1 通過抑制TRPV1離子通道的水滲透進行溶劑介導(dǎo)的鎮(zhèn)痛
圖1 通過抑制TRPV1離子通道的水滲透進行溶劑介導(dǎo)的鎮(zhèn)痛有效的疼痛管理對于提高生活質(zhì)量和整體健康至關(guān)重要。TRPV1離子通道在檢測疼痛中起著關(guān)鍵作用,當被激活時,它的孔會擴大,使離子和更大的分子能夠通過。然而,水分子滲透TRPV1通道的能力仍然不確定。
創(chuàng)新納米探針跟蹤水動力學
為了解決這個問題,新加坡國立大學化學系Xiaogang Liu教授領(lǐng)導(dǎo)的研究小組開發(fā)了一種上轉(zhuǎn)換納米探針,能夠區(qū)分普通水和氘水。這種先進的技術(shù)可以在單細胞和單分子水平上實時跟蹤水動力學。研究表明,當氘水通過TRPV1通道時,可以抑制疼痛信號的傳遞,達到有效的鎮(zhèn)痛效果。這項研究是與北京大學和中國國防科技創(chuàng)新研究所的 Chang Chao教授以及在耶魯-新加坡國立大學學院期間的Zhuang Bilin助理教授合作進行的。
研究結(jié)果發(fā)表在2024年11月21日的《Nature Biomedical Engineering》雜志上。
給臨床前模型注射氘水,團隊成功地減少了急性和慢性炎癥性疼痛的傳播,而不影響其他神經(jīng)反應(yīng)。這種溶劑介導(dǎo)的鎮(zhèn)痛機制提供了一種有效的、生物相容性的、非成癮性的傳統(tǒng)止痛藥替代品,避免了與藥物依賴和耐受性相關(guān)的問題。

圖2 使用納米探針監(jiān)測單個活細胞中水環(huán)境的變化
Liu教授說:“這一發(fā)現(xiàn)不僅擴大了對TRPV1功能的科學認識,而且為疼痛管理開辟了新的途徑。研究小組的目標是進一步探索d2 O對其他離子通道的影響,潛在地將這種機制應(yīng)用于治療神經(jīng)系統(tǒng)疾病和其他醫(yī)學挑戰(zhàn)。”
“溶劑介導(dǎo)的鎮(zhèn)痛機制代表了疼痛緩解的創(chuàng)新突破,可能推動臨床使用更安全,非成癮性疼痛療法的發(fā)展,”Liu教授補充說。
參考資料
[1] Solvent-mediated analgesia via the suppression of water permeation through TRPV1 ion channels



